Hydrolab – Avhärdande filtrering
Hydrolab – Avhärdande filtrering

Vattnets hårdhet är summan av magnesium- och kalciumjoner som förekommer i alla möjliga kombinationer. I tabell 1 presenteras den huvudsakliga fördelningen av vattnets hårdhet.
| Allmän hårdhet genom katjoner | Allmän hårdhet genom anjoner |
| karbonat hårdhet | icke-karbonat hårdhet | |
| kalciumhårdhet | Ca(HCO3)2, Ca(OH)2, CaCO3 | CaSO4, CaCl2, Ca(NO3)2 |
| magnesium hårdhet | Mg(HCO3)2, Mg(OH)2, MgCO3 | MgSO4, MgCl2, Mg(NO3)2 |
Typer av vattenhårdhet:
– Kalcium-/magnesiumhårdhet orsakas av upplösta kalcium-/magnesiumsalter.
– karbonat (övergående) hårdhet är förknippad med närvaron av föreningar i form av kalcium- och magnesiumhydroxider, bikarbonater och karbonater. Efter kokning försvinner denna del av den totala hårdheten i vattnet.
– Icke-karbonathårdhet (permanent) orsakas av förekomsten av främst kalcium- och magnesiumsalter. Oftast är det sulfater, som bildar gipssten som är svår att avlägsna, t.ex. CaSO4 och klorider[2].
Enheter:
| enheter | mmol/1 | mial/l | på | oang | ofranc | mg CaCO3/l |
| mmol/l | 1 | 2 | 5,61 | 7,02 | 10 | 100 |
| mval/l | 0,5 | 1 | 2,8 | 3,5 | 5 | 50 |
| på | 0,178 | 0,356 | 1 | 1,25 | 1,78 | 17,0 |
| oang | 0,143 | 0,286 | 0,8 | 1 | 1,43 | 14,0 |
| ofranc | 0,1 | 0,2 | 0,56 | 0,7 | 1 | 1 |
| mg CaCO3/l | 0,01 | 0,02 | 0,056 | 0,07 | 0,1 | 1 |
Enligt hälsoministeriets förordning måste vattenhårdheten i dricksvatten ligga inom intervallet 60-500 mg CaCO3/l3/l
Tab. 3 Klassificering av vatten enligt allmän hårdhet [2].
| vatten | mg CaCO3 |
| mycket mjuk | 100-200 |
| mjuk | 100-200 |
| medium mjuk | 200-350 |
| hård | 350-550 |
| mycket svårt | >550 |
Avhärdning av vatten är avlägsnandet av joner som är ansvariga för vattnets hårdhet genom att leda vatten genom natriumkatjon. När vattnet rinner genom jonbytarhartset byts kalciumjoner(Ca2+) och magnesiumjoner(Mg2+) ut mot natriumjoner(Na+).
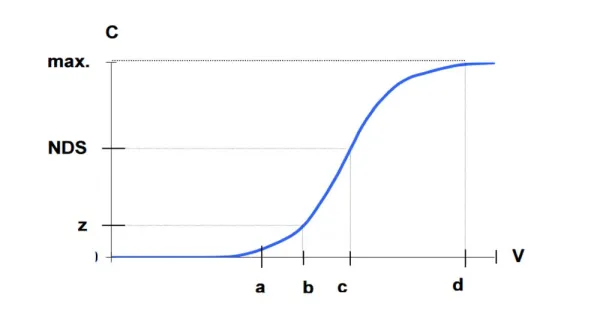
Längden på jonbytaren beror främst på: – jonbytarens arbetsutbyteskapacitet, – mängden utbytta joner, – bäddens förberedelse för jonbytet. Jonbytesprocessen varar till “bäddens genombrott”, dvs. när den antagna koncentrationen av utbytta joner i den renade lösningen har uppnåtts (fig. 1) [3].